11月3日,《自然·通讯》 (Nature Communications)在线发表了武汉光电国家实验室(筹)张玉慧教授团队的最新研究成果《用于活细胞长时程超分辨成像的透膜有机荧光探针揭示了溶酶体和线粒体的相互作用》(Cell-permeable organic fluorescent probes for live-cell long-term super-resolution imaging reveal lysosome-mitochondrion interactions)。
越来越多研究表明细胞中的各种细胞器形成一个复杂的动态网络并在各种生命活动中进行协同合作而非独立工作。作为细胞中两种重要的细胞器,溶酶体和线粒体在很多重要的生理过程中发挥着重要作用,其功能紊乱涉及到多种疾病,如:神经退行性疾病、心脏疾病以及癌症等。然而,到目前为止,对溶酶体和线粒体之间的动态相互作用研究鲜有报道,甚至在哺乳动物细胞中溶酶体和线粒体之间是否存在物理相互作用都未可知。这主要是因为它们之间的相互作用位点是在纳米量级,远远超出了常规光学荧光显微镜的分辨极限。作为近年来发展起来的超分辨荧光显微成像技术之一,结构光照明显微成像技术(SIM),因同时具有较高的时间和空间分辨率,为观测活细胞内细胞器之间的动态相互作用提供了一种非常有效的工具。然而,到目前为止,利用SIM技术进行溶酶体和线粒体动态相互作用研究仍具有很大的挑战性,主要是因为现有能用于活细胞标记的溶酶体及线粒体荧光探针具有易光漂白及非特异性标记等问题。
张玉慧教授团队构建了一系列新型能特异性标记活细胞内溶酶体的透膜有机荧光探针。该系列荧光探针具有特异性高、光稳定性高及多色可选等优点。利用这类新型荧光探针及SIM技术,首次在超分辨水平记录了活细胞内溶酶体融合-分裂的连续动态过程。同时,还成功发展了一种高亮度、抗漂白的荧光染料作为活细胞线粒体荧光探针。利用以上两类荧光探针,实现了对溶酶体及线粒体长达13分钟的双色SIM超分辨成像,首次在活细胞中揭示了四种溶酶体和线粒体的动态相互作用。此项研究成果将为在活细胞中进一步研究溶酶体和线粒体的功能及动态相互作用提供新的工具和方法。
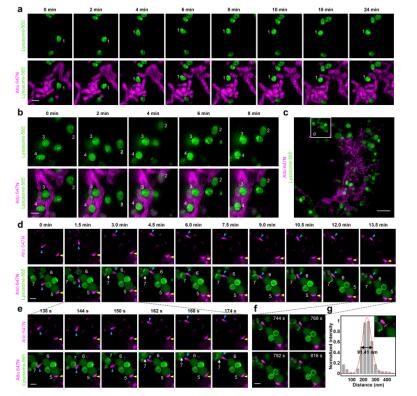
图1.双色SIM超分辨动态成像
(绿色:溶酶体;紫色:线粒体)。(a,b,d,e,f)四种不同溶酶体和线粒体的动态相互作用;(c)一个完整细胞的双色SIM超分辨图;(g)f中线粒体管状结构的半高全宽。
此项工作由武汉光电国家实验室(筹)生物医学光子学功能实验室韩于冰、李梅花、仇丰武、张朦及张玉慧(通讯作者)共同完成。
该工作得到了“973”计划、国家自然科学基金面上项目、国家自然科学基金创新群体、华中科技大学学术前沿青年团项目等的支持。